Átomos, iões e as suas nuvens eletrónicas
Os electrões dos átomos distribuem-se por níveis de energia. O número máximo de electrões num nível de energia (n), calcula-se pela expressão: 2xn ao quadrado. O número máximo de electrões no último nível é oito. Os electrões do último nível de energia chamam-se electrões de valência. Os átomos transformam-se em iões quando perdem ou ganham electrões. Átomos com poucos electrões de valência perdem electrões e originam iões positivos ou catiões. Átomos com bastantes electrões de valência captam electrões e originam iões negativos ou aniões. Os electrões dos iões distribuem-se também por níveis de energia.
 |
| n= níveis de energia |
Os átomos de um elemento
O número atómico de um elemento Z corresponde ao número de protões existentes no núcleo dos átomos ou dos iões monoatómicos. Cada elemento químico é caracterizado pelo seu número atómico. Z=número de protões.
O número de massa de um átomo A é a soma do número de protões e neutrões. A=número de (protões + neutrões).
Isótopos são átomos diferentes do mesmo elemento químico. Têm o mesmo número atómico mas diferente número de massa. Cada isótopo de um elemento é caracterizado pelo seu número de massa.

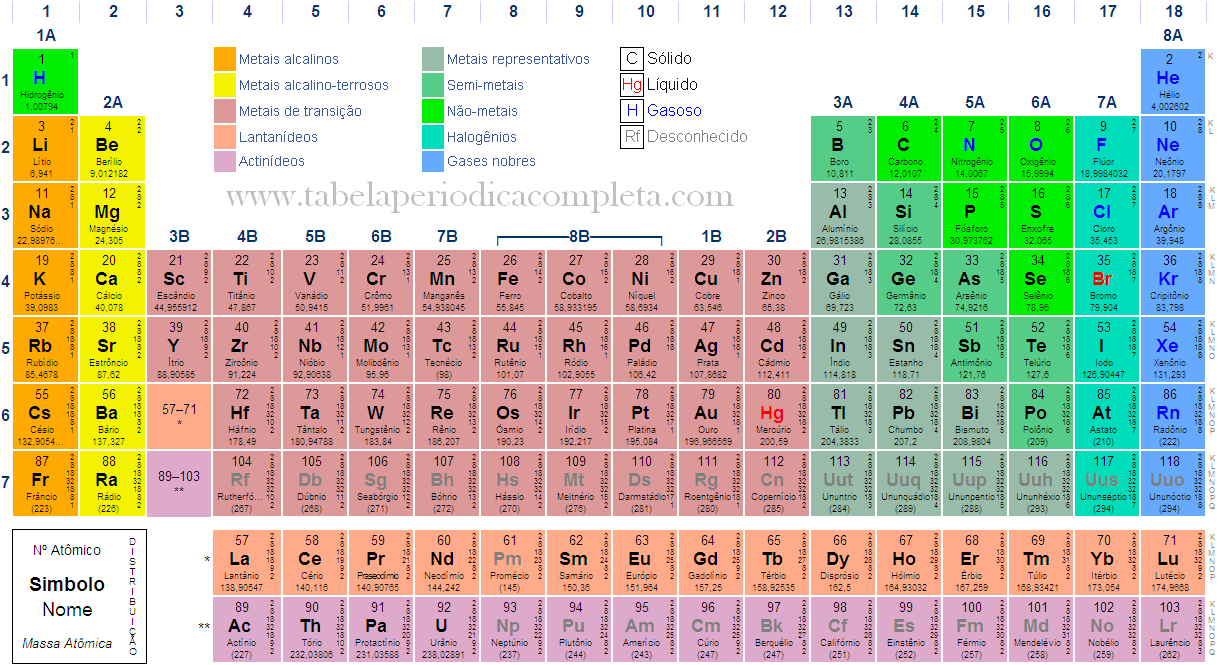
Tabela Periódica dos elementos
Na Tabela Periódica actual:
- os elementos estão dispostos por ordem crescente de número atómico;
- cada linha horizontal chama-se período e cada coluna vertical designa-se por grupo
- há 7 períodos e 18 grupos
- no mesmo período, todos os átomos têm os electrões distribuídos pelo mesmo número de níveis de energia
- no mesmo grupo, todos os átomos têm o mesmo número de electrões de valência
- o tamanho do átomos ao longo de cada período diminui mas ao longo de cada grupo aumenta
Das propriedades das substâncias á posição dos elementos na Tabela Periódica
Metais Alcalinos:
- São muito reactivos
- Os átomos que têm 1 electrão de valência originam facilmente iões de carga +1
- A reactividade aumenta ao longo do grupo
Metais Alcalino-Terrosos
- São bastante reactivos
- Os átomos que têm 2 electrões de valência originam facilmente iões de carga +2
- A reactividade aumenta ao longo do grupo
- São muito reactivos
- Os seus átomos que têm electrões de valência , transformam-se facilmente em iões de carga -1
- A reactividade diminui ao longo do grupo
São muito estáveis, pois os seus átomos têm o número máximo de electrões de valência


Sem comentários:
Enviar um comentário